热力学定律 thermodynamics laws
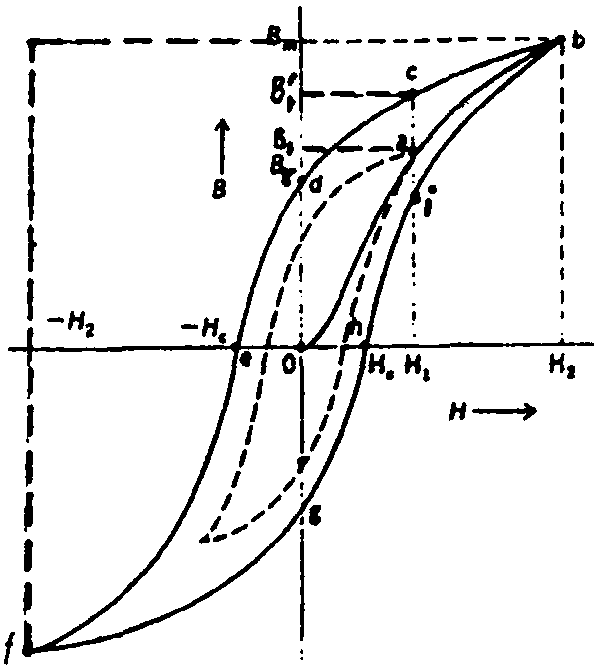
作为热力学基础的三个基本定律。即:①热力学第一定律。这是一个用热功和内能表示的能量守恒定律。该定律指出: “体系从环境吸收的热(δq)等于体系内能的增加(dE)和它对外作的功(δW)之和”。用微分形式表示为δq=dE+δW。其中功δW包括膨胀功δW v(由于体系体积膨胀而反抗外压作的功)和有用功δWu(如电功、界面能等)。在通常的热力学过程中都不作有用功,故热力学第一定律可写为:δq=dE+δWv=dE+PdV。②热力学第二定律。原始表述有多种,大体可归为两类: 第一类是关于热功转换的方向性(不可逆性)。典型的表述为:“热不可能全部变成功而不在环境中留下任何影响”,“不可能造出这样一台 ...... (共1689字) [阅读本文]>>

 上一篇
上一篇