2.3.3 吉布斯能和反应方向
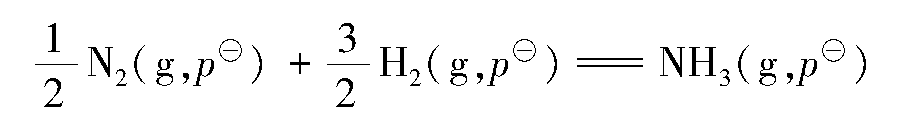
(1)吉布斯能减少原理
为了判断等温等压化学反应的方向性,1876年,美国科学家吉布斯(Gibbs)综合考虑了焓和熵两个因素,提出一个新的状态函数G——吉布斯能(Gibbs energy),其数学表达式如式(2.17)所示:
GH-TS
(2.17)
吉布斯证明了系统吉布斯能变可以用系统在等温等压的可逆过程中对外做的最大非体积功来量度,如式(2.18)所示:
-△G=Wf,最大
(2.18)
等温等压自发的化学反应则可做非体积功,所以当Wf,最大>0,即△G<0时,反应自发;反之,是非自发的。由此可得等温等压条件下化学反应方向的判据为:
△G<0,正向反应自发进行
△G=0,化学反应达到平衡
△G>0,逆向反应自发进行
这就是吉布斯能减少原理(pr ...... (共2763字) [阅读本文]>>

 上一篇
上一篇