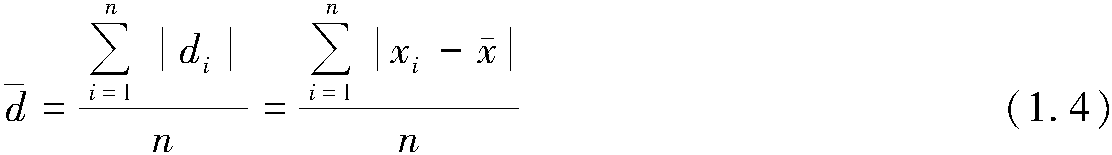2.1.5 焓
对于某封闭系统,在非体积功Wf为零的条件下经历某一等容过程,因为△V=0,所以体积功为零。此时,热力学第一定律的具体形式为:
△U=QV
(2.2)
QV为等容过程的热效应。式(2.2)的物理意义是:在非体积功为零的条件下,封闭系统经一等容过程,系统所吸收的热全部用于增加体系的内能。
对于封闭系统,在非体积功Wf为零且等温等压(p1=p2=p外)的条件下的化学反应,热力学第一定律的具体形式为:
△U=U2-U1=Qp-p(V2-V1)
Qp为化学反应的等压热效应,整理上式得
U2-U1=Qp-p2V2+p1V1
Qp=(U2+p2V2)-(U1+p1V1)
HU+pV
(2.3)
H称为焓(Enthalpy),是热力学中一个极其重要的状态函数。从式(2.3)得:
△H=H2-H1=(U2+p2V2)-(U1+p1V1)=Qp
即
△H=Qp
(2.4)
...... (共894字) [阅读本文]>>

 上一篇
上一篇