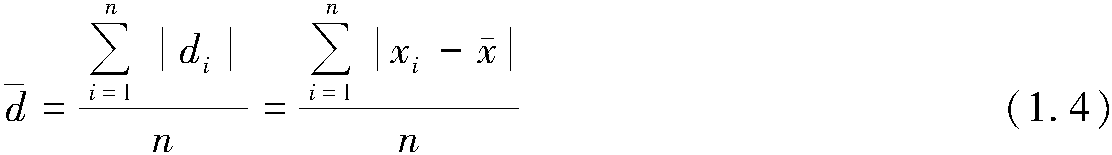2.2.4 盖斯定律和化学反应热的计算
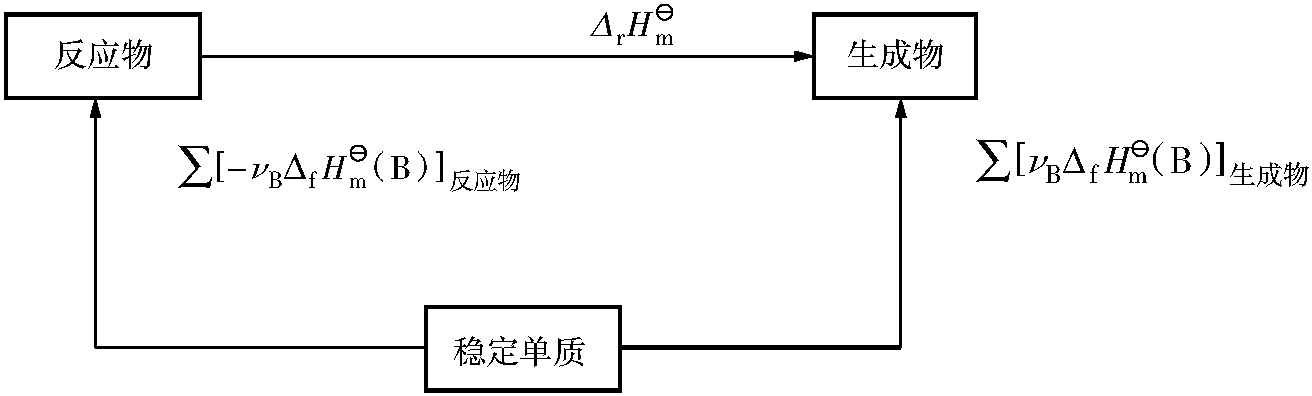
1840年,瑞士籍俄国科学家盖斯(G.H.Hess)在总结大量反应热效应的数据后提出了一条规律:一个化学反应不论是一步完成还是分几步完成,其热效应总是相同的。这就是盖斯定律(Hess's law),是热力学第一定律的必然结果,它只对等容反应或等压反应才是完全正确的。盖斯定律揭示了在条件不变的情况下,化学反应的热效应只与起始和终止状态有关,而与变化途径无关。
对于等压反应:Qp=△rH
对于等容反应:QV=△rU
由于△rH和△rU都是状态函数的改变量,它们只决定于系统的始态和终态,与反应的途径无关。因此,只要化学反应的始态和终态确定了,热效应Qp和QV便是定值,与反应进行的途径无关。
盖斯 ...... (共3248字) [阅读本文]>>

 上一篇
上一篇